LIMS实验室信息化管理系统对数据审查如何控制?
2020-02-07 11:50
实验室检测分析需确保数据完整性的关键之一是第二人审核。在美国GMP法规可在21 CFR 211.194(a)(8)(6)中找到,并说明:
The initials or signature of a second person showing that the original records have been reviewed for accuracy, completeness, and compliance with established standards.
第二人的姓名首字母或签名,表明原始记录已经过审查,准确性,完整性和符合既定标准。
随着FDA关于数据完整性的指南草案的公布(3),第二人审查还进一步要求检测任何伪造数据的企图:
16. Should personnel be trained in detecting data integrity issues as part of a routine CGMP training program?
16.作为常规CGMP培训计划的一部分,是否应培训人员检测数据完整性问题?
Yes. Training personnel to detect data integrity issues is consistent with the personnel requirements under § 211.25, which state that personnel must have the education, training, and experience, or any combination thereof, to perform their assigned duties.
是。培训人员检测数据完整性问题符合§211.25中的人员要求,该要求规定人员必须具有教育,培训和经验,或其任何组合,以履行其指定的职责。
因此,作为第二人审核的一部分,需要花费更多时间来检查是否有任何数据被操纵或伪造。这将降低数据审查速度,特别是对于混合系统。
另一个要求是明确审查与分析相关的审计追踪信息,该信息包含专门针对该主题的18个问题中的两个:
7. How often should audit trails be reviewed?
FDA recommends that audit trails that capture changes to critical data be reviewed with each record and before final approval of the record. Audit trails subject to regular review should include, but are not limited to, the following: the change history of finished product test results, changes to sample run sequences, changes to sample identification, and changes to critical process parameters.
FDA recommends routine scheduled audit trail review based on the complexity of the system and its intended use.
7.审核跟踪的频率应该多久检查一次?
FDA建议在每条记录和最终批准记录之前,审核获取关键数据变更的审计追踪。需要定期审核的审计追踪应包括但不限于以下内容:成品测试结果的更改历史记录,样本运行顺序的更改,样本标识的更改以及关键过程参数的更改。
FDA建议根据系统的复杂性及其预期用途进行例行的计划审计追踪审查。
新指南使FDA的要求与欧盟GMP附件11(8)保持一致,其中第9条要求定期审查审计追踪,并根据风险对审查的频率进行评估。
8. Who should review audit trails?
Audit trails are considered part of the associated records. Personnel responsible for record review under CGMP should review the audit trails that capture changes to critical data associated with the record as they review the rest of the record (for example, §§ 211.22(a), 211.101(c), 211.194(a)(8), and 212.20(d)). For example, all production and control records, which includes audit trails, must be reviewed and approved by the quality unit (§ 211.192). This is similar to the expectation that cross-outs on paper be assessed when reviewing data.
8.谁应该审核审计线索?
审计追踪被视为相关记录的一部分。在CGMP下负责记录评审人员在评审记录的其余部分时,应评审获取与记录相关关键数据更改的审核跟踪(例如,§§211.22(a),211.101(c),211.194(a)(8)和212.20(d))。例如,所有生产和控制记录(包括审计追踪)必须由质量部门审核和批准(§211.192)。这类似于在审查纸质记录时评估纸上划掉的数据。
可以看出,审查审计追踪的人就是第二审核人。我们再通过LIMS和CDS系统探索这在实践中意味着什么。
8. 第二人如何审计
我们需要考虑一批样本的数据和元数据是审查的主要元素。在开始讨论之前,先做个假设:
1. 整个过程是电子化的,并使用电子签名。签名的位置不同有不同的实现方式,但有两种主要方法:第一种是登录CDS(测试人),然后是LIMS(审核人),或者都在LIMS中完成(测试人和审核人)。
2. 确保软件都经过系统验证,并且两个系统应用程序中的配置都做好了保护电子记录的设置。
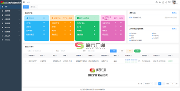
第二人审查的范围应涵盖从样本存储到可出报告结果的分析全过程,这里我们只说LIMS和CDS两个系统。第二人审查从CDS开始,包括用于分析的色谱仪,并在LIMS中完成审查。
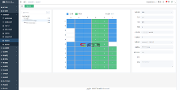
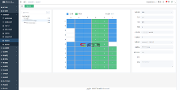
现在我们必须考虑第二人审稿人必须审查的内容:数据和相关元数据,如图3所示。问题是,在基于风险的世界中,我们要考虑如何满足FDA指南(3)和欧盟GMP附件11(8)的要求?
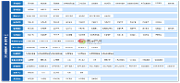
表1列出了审查中需要考虑的主要问题以及侧重于第二人审查的基于风险的方法。重点主要放在电子记录上,而不是重复,不是一种全面的方法。
审查内容在表1的左栏,审查的考虑因素在表格中间和右边。审查分为初次和二次。主要是每次进行第二次人员审查时应关注的重点,而次要是技术控制和验证提供支持的地方,以便防止出现糟糕的数据管理或伪造数据。并不是说审稿人要忽略了这些方面,而是基于风险的方法让他们将审查重点放在软件中的电子工作流程未执行到的区域或者手动输入的区域,因为这些是更可能发生数据管理或错误的区域。
理想情况下,应用程序可以帮助审查。例如,CDS应用程序具有可以审查审计追踪条目的功能,并且通过按下按钮,可以将审阅者的名称和时间戳输入到样本的审计追踪中。其他帮助审核流程的方法有通过颜色或其他方式在审核跟踪中突出显示更改,审核人员将集中关注在那里。
LIMS可用于帮助确保受监管实验室内数据完整性的方法,但最好的方法是以电子方式工作完全取代纸质记录。所以好的LIMS软件加上对法规的深度解读和应用,才能使实验室和软件程序变得更加高效,从而强制执行正确的方法以符合法规要求,最终确保数据完整性。